6 Senyawa pembentuk larutan elektrolit. Senyawa ion terbuat dari ikatan ion di mana gaya elektrostatis atom saling tarik menarik antara satu sama lain.
Perhatikan Beberapa Zat Berikut Asam Klorida
Larutan Elektrolit Senyawa Ion dan Senyawa Kovalen.
. Senyawa kovalen polar hanya dapat menghantarkan listrik dalam larutan. 62 Senyawa kovalen polar. Senyawa ionic dan senyawa kovalen merupakan senyawa yang mampu menghantarkan listrik karena dapat terurai menjadi.
Pada suhu kamar berbentuk gas ada juga yang berwujud cair dan padat. Akan tetapi cairan senyawa ion akan menghantarkan listrik karena ion-ionnya menjadi lepas dan bebas. Senyawa kovalen terbuat dari ikatan kovalen dimana transfer elektron terjadi antara atom yang terlibat dalam formasi.
Senyawa kovalen polar hanya dapat menghantarkan listrik dalam larutan dan senyawa kovalen nonpolar tidak dapat menghantarkan listrik. Senyawa kovalen dan ionik memiliki beberapa. Dalam bentuk padatan solid senyawa ion tidak dapat.
Banyak perbedaan yang dapat dicatat antara senyawa ionik dan kovalen berdasarkan sifat makroskopiknya seperti kelarutan. Senyawa ion juga dapat menghantarkan listrik bila dilarutkan dalam pelarut polar misalnya air karena terionisasi. Senyawa ion berwujud padat tidak menghantarkan listrik karena ion positif dan negatif terikat kuat satu sama lain.
Oleh sebab itu larutan yang bersumber dari. Penghantaran arus listrik. Namun dalam bentuk larutan suatu elektrolit baik atau buruknya menghantarkan listrik pada senyawa kovalen polar dalam wujud larutannya tergantung dari perbedaan.
Senyawa ion yang terbentuk dari interaksi elektrostatik yang kuat antara ion yang menghasilkan titik leleh yang lebih tinggi dan konduktivitas listrik dibandingkan dengan senyawa kovalen. Banyak perbedaan yang dapat dicatat antara senyawa ionik dan kovalen berdasarkan sifat makroskopiknya seperti kelarutan dalam air konduktivitas listrik titik leleh. Senyawa ion memiliki ikatan ion dalam bentuk lelehan dan larutan dapat terionisasi sempurna menghasilkan ion-ion yang dapat bergerak bebas.
Larutannya dapat menghantarkan listrik. Senyawa kovalen memiliki titik didih dan titik leleh yang rendah. Itu artinya dalam bentuk larutan ada juga senyawa kovalen yang sanggup menghantarkan listrik contohnya senyawa HCl HNO 3 dan CH 3 COOH.
Dua jenis ikatan adalah ikatan. Senyawa kovalen tidak larut dalam pelarut polar namun larut dalam pelarut organik. Karena berbagi elektron mereka menunjukkan sifat fisik karakteristik yang meliputi.
Senyawa kovalen polar hanya dapat menjadi konduktor yang baik jika dilarutkan dengan menggunakan zat pelarut yang tepat. Titik didih dan titik leleh senyawa logam lebih tinggi dari senyawa ion senyawa ion lebih tinggi dari senyawa kovalen. Senyawa ion terjadi melalui interaksi antara kation dan anion.
Sifat-sifat senyawa kovalen adalah. Senyawa kovalen terjadi melalui interaksi atom netral. Pernyataan berikut benar tentang zat elektrolit kecuali.
Untuk memahami perbedaan wujud senyawa ionik dan kovalen polar ini berikut penjelasannya. Senyawa kovalen memiliki ikatan di mana elektron dibagi antara atom. Perbedaan Kunci - Senyawa Ionic vs Kovalen.
Meski sebagian molekul penyusun senyawa kovalen bersifat nonpolar namun sebagian molekul juga sanggup bersifat polar sehingga dikenal sebagai pelarut polar. Dapat berupa senyawa ion maupun kovalen. Dalam air terionisasi menjadi kation dan anion.
Padatan wujud ini tidak dapat menghantarkan listrik. Senyawa ionik adalah senyawa yang atom. Meski demikian senyawa kovalen dan ionik memiliki beberapa perbedaan dalam menghantarkan arus listrik.
Senyawa ion dapat menghantarkan arus listrik dalam wujud lelehan dan larutan sedangkan senyawa kovalen polar hanya menghantarkan dalam bentuk larutan senyawa kovalen nonpolar tidak dapat menghantarkan sama sekali. Untuk senyawa ion ikatan ion yaitu senyawa yang terbentuk dari logam dan non logam yang berikatan ion. Kecuali jika ikatan kovalen polar tersebut terputus secara heterolitik pemutusan ikatan dengan pembagian elektron tidak sembang hingga membentuk ion positif dan ion.
Top 10 Jelaskan Perbedaan Daya Hantar Listrik Dari Senyawa Ion Dan Senyawa Kovalen Yang Berupa Padatan 2022
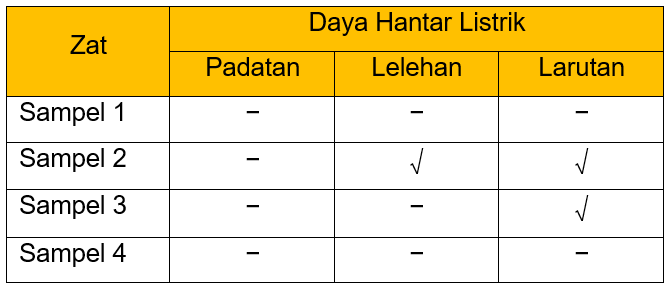
Disajikan Data Hasil Pengujian Daya Hantar Listrik
Di Antara Zat Murni Yang Diuji Golongan Zat Yang Dapat Menghantarkan Listrik Mas Dayat
Larutan Elektrolit Dan Non Elektroli Syaht
Perbedaan Sifat Senyawa Ion Dan Senyawa Kovalen Po
Perbedaan Senyawa Ion Senyawa Kovalen Dan Lo Utakatikotak Com
Data Hasil Pengujian Daya Hantar Listrik Berbagai
Mengapa Lelehan Senyawa Kovalen Polar Tidak Dapat Menghantarkan Listrik Sedangkan Lelehan Ion Dapat Menghantarkan Listrik
Perbedaan Senyawa Ion Dan Senyawa Kovalen Youtube
Mengapa Lelehan Atau Leburan Senyawa Ion Dapat Menghantarkan Listrik Sedangkan Senyawa Kovalen Tidak Dapat Menghantarkan Listrik
Diketahui Data Fisik Dua Buah Senyawa Sebagai Beri
Ciri Ciri Dari Senyawa Ion Dan Senyawa Kovalen Brainly Co Id
Bandingkan Sifat Senyawa Ionik Dan Senyawa Kovalen
Tabel Berikut Merupakan Hasil Pengujian Daya Hanta
Pengertian Sifat Dan Contoh Dari Senyawa Ion Panduan Kimia Riset
Sebutkan Perbedaan Sifat Antara Senyawa Ion Dengan Senyawa Kovalen Brainly Co Id
Fase Apakah Senyawa Ion Dan Senyawa Kovalen Polar Dapat Menghantarkan Arus Listrik
Modul Rumus Soal Sifat Fisis Senyawa Wardaya College
- undefined
- perbedaan senyawa ion dan kovalen dalam menghantarkan listrik
- cenderahati hari guru online
- nota geografi tingkatan 2
- gambar daun flamingo
- kata mutiara untuk orang yang serakah
- syarikat air darul aman
- jawatan kosong petaling jaya
- 12 bidang ekonomi utama negara
- lembaga getah malaysia kedah
- eco tower sdn bhd
- selamat hari raya quotes in english
- hsbc amanah malaysia berhad
- cara buat air halia
- what is tax relief
- diet telur simple
- kenapa demam anak susah turun
- bukit fraser in chinese
- takaso rubber products sdn bhd
- pegawai teknologi maklumat gred f41
